Cybin riceve dalla FDA la designazione di terapia innovativa Breakthrough Therapy per la sua nuova molecola psichedelica CYB003 e annuncia dati positivi a quattro mesi per il disturbo depressivo maggiore
Cybin Inc. (NYSE American:CYBN) (Cboe CA:CYBN) ("Cybin" o l'"Azienda"), un'azienda biofarmaceutica di ambito clinico che si dedica a rivoluzionare la salute mentale sviluppando nuove opzioni di trattamento innovative a base di sostanze psichedeliche di prossima generazione, ha annunciato oggi che la FDA ha concesso la denominazione BTD a CYB003, l'analogo deuterato della psilocibina di sua proprietà in sviluppo per la terapia aggiuntiva dell'MDD.
Questo comunicato stampa include contenuti multimediali. Visualizzare l’intero comunicato qui: https://www.businesswire.com/news/home/20240313102537/it/
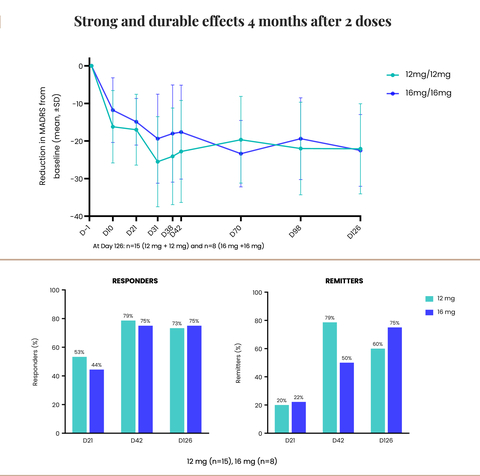
Strong and durable effects 4 months after 2 doses (Graphic: Business Wire)
Il testo originale del presente annuncio, redatto nella lingua di partenza, è la versione ufficiale che fa fede. Le traduzioni sono offerte unicamente per comodità del lettore e devono rinviare al testo in lingua originale, che è l'unico giuridicamente valido.
Vedi la versione originale su businesswire.com: https://www.businesswire.com/news/home/20240313102537/it/
Copyright Business Wire 2024Investitori e media:
Gabriel Fahel
Responsabile dell'ufficio legale
Cybin Inc.
1-866-292-4601
[email protected] – oppure –
[email protected]
Permalink: http://www.businesswire.com/news/home/20240313102537/it/




